De nombreux chercheurs ont identifié l’impact potentiel des biomarqueurs sanguins cliniquement utiles associés au TC sur la prise en charge des patients dans le SU
De nombreux chercheurs ont identifié l’impact potentiel des biomarqueurs sanguins cliniquement utiles associés au TC sur la prise en charge des patients dans le SU
Dans un article de synthèse approfondi paru dans la publication Proteomics – Human Diseases and Protein Functions, Exploring the Role of Biomarkers for the Diagnosis and Management of Traumatic Brain Injury Patients, le Dr Papa aborde les différents avantages potentiels des biomarqueurs pour le TC. Ces avantages pourraient inclure l’amélioration de la stratification des patients selon la gravité des lésions ; la détection de micro-lésions cérébrales indétectables au scanner ; l’amélioration de l’évaluation des patients en état d’ébriété, inconscients, sous sédation ou polytraumatisés ; et l’identification des patients susceptibles de souffrir de séquelles à long terme1.
Dans un article publié en 2019 dans la revue The Lancet Neurology, Yue et alii suggèrent que l’utilisation de biomarqueurs pourrait améliorer le délai et la précision du diagnostic, et orienter les stratégies de traitement et de surveillance2.
L’impact potentiel de l’utilisation de biomarqueurs dans la prise en charge de patients potentiellement atteints de TC fait l’objet d’une description plus détaillée par Bazarian et al. Dans un article de 2018 paru dans The Lancet Neurology, les chercheurs affirment que jusqu’à un tiers des scanners cérébraux effectués dans le cadre de soins critiques pour évaluer le TC pourraient être évités, avec un taux de faux négatifs très faible. De plus, l’utilisation clinique de biomarqueurs permettrait de réduire le nombre de scanners cérébraux inutiles ainsi que l’exposition aux rayonnements et le coût qui leur sont associés3.
Dans un article publié en 2018 dans The Western Journal of Emergency Medicine, Michelson et al soutiennent que la réduction des scanners inutiles dans les services d’urgence pourrait améliorer les performances du SU, accélérer la mise en place de la sortie des patients et réduire la durée du séjour4.
Korley et al soulignent combien il est important de transformer la prise en charge des TC grâce à l’amélioration du diagnostic. Dans un article publié en 2015 dans The Journal of Head Trauma Rehabilitation, les auteurs affirment que « … la nécessité de nouveaux diagnostics pour optimiser la précision, l’efficacité et la rentabilité de l’évaluation [des TC] constitue un enjeu de santé publique majeur5. »
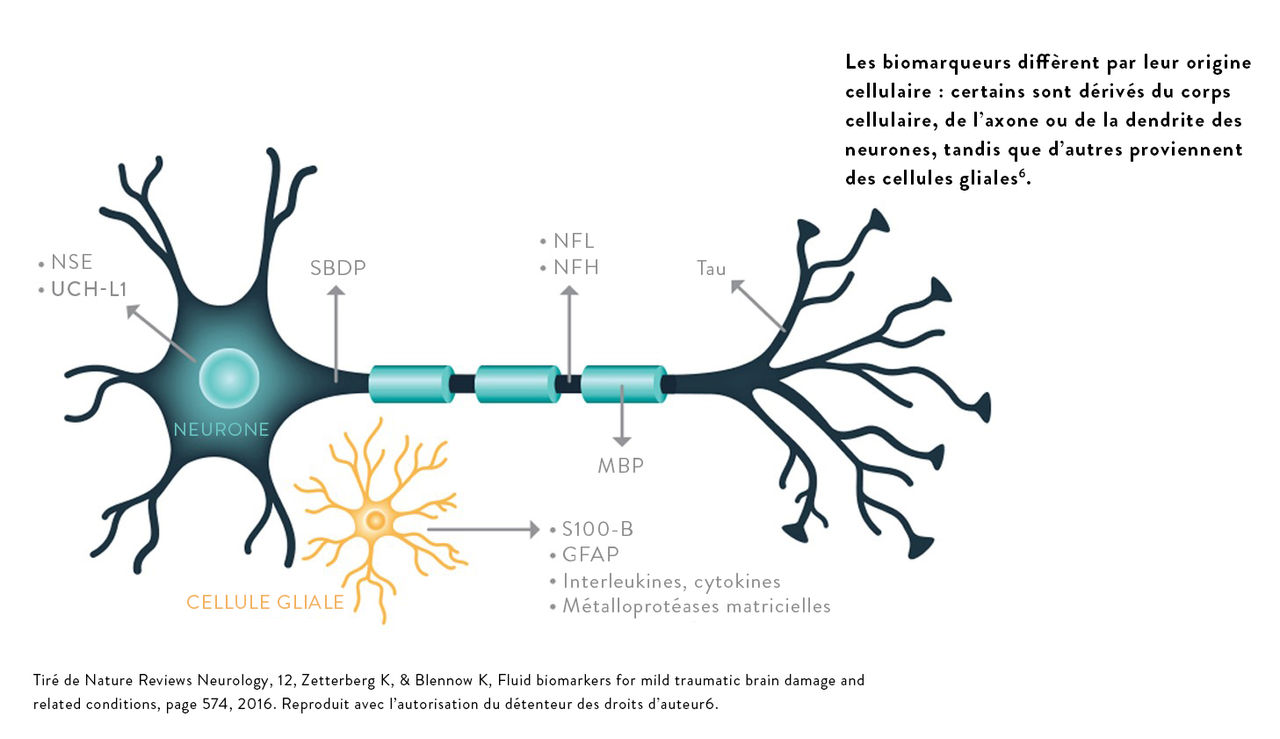
Les TC affectent différentes voies physiopathologiques du système nerveux central. Les dosages de biomarqueurs cérébraux peuvent détecter des protéines spécifiques du cerveau et fournir des informations quantitatives objectives permettant de faciliter l’évaluation des TC.
« À la suite d’un traumatisme crânien, les cellules endothéliales cérébrovasculaires subissent souvent des déformations mécaniques, ainsi que des lésions de cisaillement, qui entraînent une augmentation de la perméabilité des jonctions serrées et une fuite de molécules à travers la barrière hématoencéphalique. Théoriquement, ces événements peuvent provoquer une augmentation des concentrations de molécules dérivées du SNC dans le sang et des molécules dérivées du sang dans le LCR6. »
– Zetterberg, Blennow
Pour que les biomarqueurs aient une valeur diagnostique dans le SU, certaines caractéristiques sont considérées comme essentielles7,8.



Les niveaux de biomarqueurs doivent être détectables dans le sang périphérique peu de temps après l’apparition de la lésion



La sensibilité du biomarqueur doit être suffisamment élevée pour détecter les lésions légères



Les niveaux élevés de biomarqueurs doivent être spécifiques au traumatisme crânien
Restez au fait de la recherche sur les biomarqueurs.


Il a été démontré que l’hydrolase C-terminale de l’ubiquitine (UCH-L1), une protéine impliquée dans le métabolisme de l’ubiquitine, est présente en grande quantité dans le sérum peu de temps après un traumatisme crânien. Des augmentations de l’UCH-L1 sanguine ont été détectées dans le sérum de patients atteints de TC légers et modérés dans l’heure suivant la blessure9. Les taux mesurés dans les 4 heures suivant la blessure étaient significativement plus élevés chez les personnes présentant des lésions dues à un TC au scanner que chez celles dont l’aspect intracrânien était normal au scanner9. Il a été démontré que les taux sanguins d’UCH-L1 permettent de distinguer les patients présentant un TCL des patients sans traumatisme crânien9. Les taux d’UCH-L1 étaient beaucoup plus élevés chez les patients qui nécessitaient une intervention neurochirurgicale9.
La capacité de classification pour la détection des lésions intracrâniennes au scanner à un seuil de détection d’UCH-L1 de 0,09 ng/mL a révélé une sensibilité de 100 % (IC à 95 % entre 88 et 100), une spécificité de 21 % (IC à 95 % entre 13 et 32) et une valeur prédictive négative de 100 % (entre 76 et 100)9.



L’énolase spécifique des neurones (NSE) est une enzyme présente dans les corps cellulaires neuronaux de tout le système nerveux. Il a été démontré qu’elle est présente en grande quantité dans le sérum après un traumatisme crânien9. Plusieurs rapports décrivent l’utilité de la NSE comme marqueur de lésion neuronale9-11;Parmi les inconvénients signalés en ce qui concerne l’utilisation de la NSE comme marqueur spécifique du TC, on peut citer son expression abondante dans les globules rouges8, ce qui a incité les chercheurs à utiliser une correction d’hémolyse lors de la mesure de la NSE dans le sang12.
Une étude a examiné la performance de la concentration sérique de NSE dans les 3 heures suivant la lésion pour l’identification des lésions intracrâniennes dans le TC léger et a constaté une sensibilité de 56 %, ainsi qu’une spécificité de 77 %13.



La protéine acide fibrillaire gliale (GFAP),, une protéine structurale des astrocytes, a été détectée dans le sérum quelques heures après un traumatisme crânien10. De plus, il a été démontré que la GFAP permet de distinguer de façon fiable les patients ayant subi un TCL des patients sans traumatisme crânien10. Les taux sanguins de GFAP étaient élevés chez les patients présentant des anomalies intracrâniennes traumatiques au scanner par rapport aux patients sans lésions10. La GFAP pourrait également servir à déterminer les patients nécessitant une intervention neurochirurgicale10.
La capacité de classification pour la détection des lésions intracrâniennes au scanner à un seuil de détection de GFAP-BDP de 0,035 ng/mL a révélé une sensibilité de 97 % (IC à 95 % entre 82 et 100), une spécificité de 18 % (IC à 95 % entre 11 et 28) et une valeur prédictive négative de 94 % (IC à 95 % entre 68 et 100)10.



La protéine B qui se lie au calcium S100 (S100β) est une protéine de liaison au calcium très abondante dans les astrocytes du cerveau. Plusieurs études ont établi une corrélation significative entre des taux sanguins élevés de S100β et des anomalies au scanner cérébral14-16 Des taux sériques élevés de S100β ont été associés à une incidence accrue du syndrome post-commotionnel et à une altération transitoire des facultés cognitives après un traumatisme14,17. Lors de l’évaluation de la durée des taux élevés de S100β, les valeurs ont diminué plus de 6 heures après la lésion18.
La S100β présente l’inconvénient d’être peu sensible (61 %) et d’avoir une spécificité médiocre (77 %)19, ce qui est susceptible de limiter son utilité clinique en situation d’urgence7 Des taux de S100β élevés ont été détectés chez des patients présentant des fractures et d’autres lésions extracrâniennes20-22. En outre, divers types d’activités physiques affectent les concentrations de S100β chez des athlètes apparemment en bonne santé23. La couleur de la peau semble également avoir une influence sur les concentrations de S100β, ce qui, selon les auteurs de l’étude, pourrait être lié à une expression accrue de cette protéine par les mélanocytes sains23,24.



Les taux de protéine Tau clivée (c-Tau) dans le liquide céphalorachidien (LCR) sont significativement élevés à la suite d’un TC ; cependant, les taux de c-Tau dans le sang périphérique ne permettent pas d’établir de corrélation avec la présence de lésions traumatiques au scanner. Ce phénomène est susceptible de limiter son utilité dans le diagnostic du TCL au SU11,12.



Les taux de produit de dégradation de la spectrine (SBDP) sont élevés dans le sang périphérique pour les TC modérés et graves, mais on n’observe pas cette augmentation dans les mélanocytes issus de patients présentant un TCL.25



Les patients atteints de TCL présentaient une augmentation significative des taux sériques de neurofilaments hyperphosphorylés (p-NF) aux jours 1 (P < 0,001) et 3 (P < 0,001),25 ques de neurofilaments hyperphosphorylés (p-NF) aux jours 1 (P < 0,001) et 3 (P < 0,001)25. Cependant, un décalage de 6 heures entre l’apparition de la lésion et l’augmentation dans le sang des taux de p-NF peut limiter l’utilité de ce biomarqueur comme outil de diagnostic en soins critiques de courte durée7.
Un nombre croissant de recherches ont montré que certains neurobiomarqueurs sanguins ont une plus grande utilité clinique que d’autres. Parmi ceux-ci, on trouve trois biomarqueurs largement étudiés et associés au TC : la S100β et la GFAP dans l’astrocyte, et l’UCH-L1 dans les neurones.
S100β :
GFAP et UCH-L1
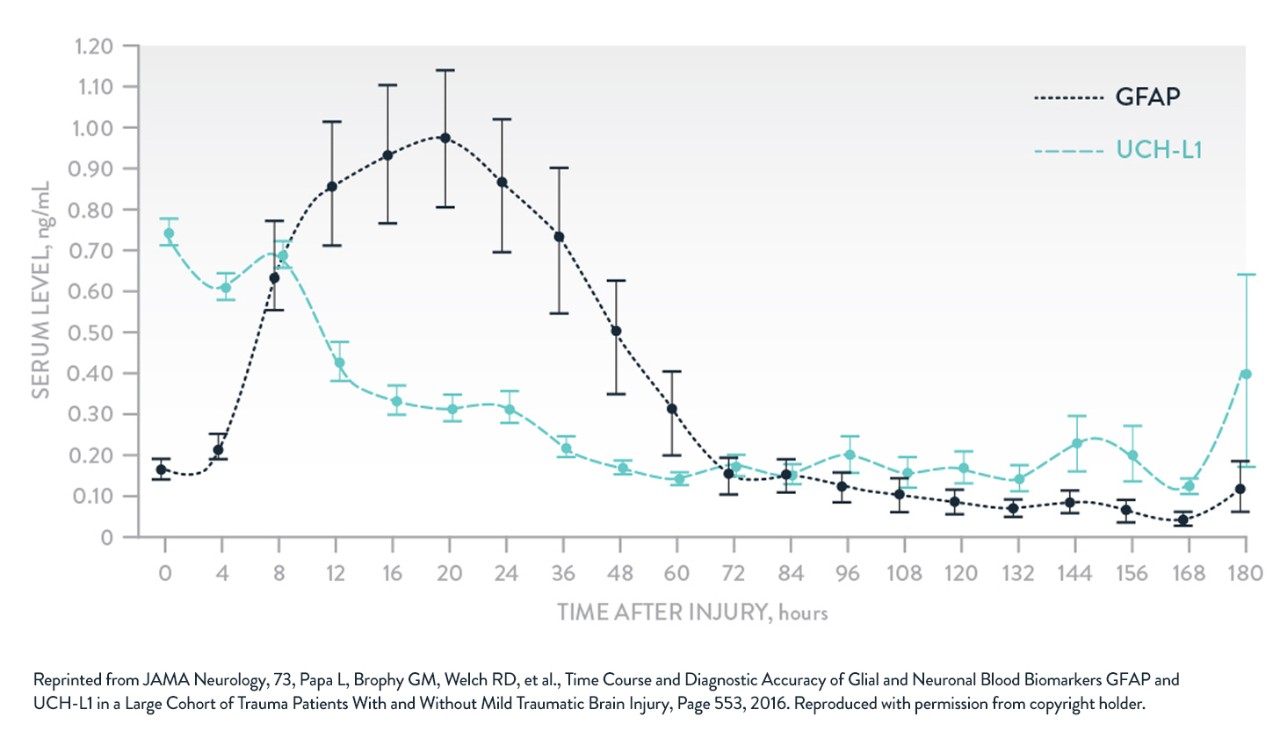
Adapté de Papa et al. JAMA Neurol. 20166
References:
1. Papa L. Exploring the role of biomarkers for the diagnosis and management of traumatic brain injury patients. INTECH Open Access Publisher. 2012. Available at: https://www.intechopen.com/books/proteomics-human-diseases-and-protein-functions/exploring-the-role-of-biomarkers-for-the-diagnosis-and-management-of-traumatic-brain-injury-patients. [Accessed Sept 19, 2018].
2. Yue JK, Yuh EL, Korley FK, et al. Association between plasma GFAP concentrations and MRI abnormalities in patients with CT-negative traumatic brain injury in the TRACK-TBI cohort: a prospective multicentre study. Lancet Neurol. 2019;18(10):953-961. doi: 10.1016/S1474-4422(19)30282-0.
3. Bazarian JJ, Biberthaler P, Welch RD, et al. Serum GFAP and UCH-L1 for prediction of absence of intracranial injuries on head CT (ALERT-TBI): a multicenter observational study. Lancet Neurol. 2018;17(9):782-789.
4. Michelson EA, Huff JS, Loparo M, et al. Emergency department time course for mild traumatic brain injury workup. West J Emerg Med. 2018;19(4):635-640.
5. Korley FK, Kelen GD, Jones CM, et al. Emergency department evaluation of traumatic brain injury in the united states, 2009–2010. J Head Trauma Rehabil. 2015;31(6):379-387.
6. Zetterberg H, Blennow K. Fluid biomarkers for mild traumatic brain injury and related conditions. Nat Rev Neurol. 2016;12(10):563-574.
7. Jones A, Jarvis P. Review of the potential use of blood neuro-biomarkers in the diagnosis of mild traumatic brain injury. Clin Exp Emerg Med. 2017;4(3):121-127.
8. Wang KK, Yang Z, Zhu T, et al. An update on diagnostic and prognostic biomarkers for traumatic brain injury. Expert Rev Mol Diagn. 2018;18(2):165-180.
9. Ergun R, Bostanci U, Akdemir G, et al. Prognostic value of serum neuron-specific enolase levels after head injury. Neurol Res. 1998;20(5):418-420.
10. Skogseid IM, Nordby HK, Urdal P,et al. Increased serum creatine kinase BB and neuron specific enolase following head injury indicates brain damage. Acta Neurochir. 1992;115:106-111.
11. Ross SA, Cunningham RT, Johnston CF, et al. Neuron-specific enolase as an aid to outcome prediction in head injury. Br J Neurosurg. 1996;10(5):471-476.
12. Verfaillie CJ, Delangh JR. Hemolysis correction factor in the measurement of serum neuron-specific enolase. Clin Chem Lab Med. 2010;48(6):891-892.
13. Kulbe JR, Geddes JW. Current status of fluid biomarkers in mild traumatic brain injury. Exp Neurol. 2016;275:334-335.
14. Ingebrigtsen T, Romner B, Marup-Jensen S, et al. The clinical value of serum S-100 protein measurements in minor head injury: a Scandinavian multicentre study. Brain Injury. 2009;14(12):1047-1055. doi: 10.1080/02699050050203540.
15. Biberthaler P, Linsenmeier U, Pfeifer KJ, et al. Serum S100B concentration provides additional information for the indication of computed tomography in patients after minor head injury. Shock. 2006;25(5):446-453.
16. Muller K, Townend W, Biasca N, et al. S100B serum level predicts computed tomography findings after minor head injury. J Trauma. 2007;62:1452-1456.
17. Waterloo K, Ingebrigtsen T, Romner B. Neuropsychological function in patients with increased serum levels of protein S-100 after minor head injury. Acta Neurochir. 1997;139:26-32.
18. Chabok SY, Moghadam AD, Saneei Z, et al. Neuron-specific enolase and S100BB as outcome predictors in severe diffuse axonal injury. J Trauma Acute Care Surg. 2012;72(6):1654-1657.
19. Nygren de boussard C, Fredman P, Lundin A, et al. S100 in mild traumatic brain injury. Brain Inj. 2004;18(7):671-683.
20. Anderson RE, Hansson LO, Nilsson O, et al. High serum S100B levels for trauma patients without head injuries. Neurosurgery. 2001;48(6):1255-1260.
21. Unden J, Bellner J, Eneroth M, et al. Raised serum S100B levels after acute bone fractures without cerebral injury. J Trauma. 2005;58:59-61.
22. Papa L, Silvestri S, Brophy GM, et al. GFAP Out-Performs S100β in Detecting Traumatic Intracranial Lesions on Computed Tomography in Trauma Patients with Mild Traumatic Brain Injury and Those with Extracranial Lesions. J Neurotrauma. 2014;31(22):1815-1822.
23. Schulte S, Podlog LW, Hamson-Utley JJ, et al. A systematic review of the biomarker S100B: implications for sport-related concussion management. J Athl Train. 2014;49(6):830-850.
24. Abdesselam OB, Vally J, Adem C, et al. Reference values for serum S-100B protein depend on the race of individuals [letter to the editor]. Clin Chem. 2003;49(5):836-837.
25. Gatson JW, Barillas J, Hynan LS, et al. Detection of neurofilament-H in serum as a diagnostic tool to predict injury severity in patients who have suffered mild traumatic brain injury. J Neurosurg. 2014;121(5):1232-1238.
26. Andres R, Mayordomo JI, Zaballos P, et al. Prognostic value of serum S-100B in malignant melanoma. Tumori. 2004;90:607-610.
27. Su YRS, Schuster JM, Smith DH, et al. Cost-effectiveness of biomarker screening for traumatic brain injury. J Neurotrauma. 2019;36:2083-2091.
28. Papa L, Brophy GM, Welch RD, et al. Time course and diagnostic accuracy of glial and neuronal blood biomarkers GFAP and UCH-L1 in a large cohort of trauma patients with and without mild traumatic brain injury. JAMA Neurol. 2016;73(5):551-560.
29. Diaz-Arrastia R, Wang KKW, Papa L, et al. Acute biomarkers of traumatic brain injury: relationship between plasma levels of ubiquitin C-terminal hydrolase-L1 and glial fibrillary acidic protein. J Neurotrauma. 2014;31(1):19-25.
30. Takala RSK, Posti JP, Runtti H, et al. Glial fibrillary acidic protein and ubiquitin c-terminal hydrolase-L1 as outcome predictors in traumatic brain injury. World Neurosurg. 2016;87:8-20.
Abbott ne contrôle pas les liens qui vous dirigent hors des sites Web internationaux d’Abbott et Abbott n’est pas responsable du contenu de ces sites ou de tout autre lien provenant de ces sites. Abbott vous fournit ces liens à titre de référence uniquement, et l’inclusion d’un lien ne signifie aucunement qu’Abbott approuve le site correspondant. Le site Web que vous avez demandé peut également ne pas être optimisé pour la taille de votre écran.
Cliquez sur oui si vous êtes un professionnel de santé.