Zahlreiche Forscher haben den potenziellen Einfluss von klinisch nützlichen Blut-Biomarkern im Zusammenhang mit SHT auf die Patientenversorgung in der Notaufnahme identifiziert
Zahlreiche Forscher haben den potenziellen Einfluss von klinisch nützlichen Blut-Biomarkern im Zusammenhang mit SHT auf die Patientenversorgung in der Notaufnahme identifiziert
In einem umfassenden Übersichtsbeitrag in der Publikation Proteomics - Human Diseases and Protein Functions, Exploring the Role of Biomarkers for the Diagnosis and Management of Traumatic Brain Injury Patients diskutiert Dr. Papa verschiedene potenzielle Vorteile von Biomarkern zum Nachweis eines SHTs. Zu diesen Vorteilen können eine bessere Stratifizierung der Patienten nach Schwere der Verletzung, die Erkennung von Mikroverletzungen des Gehirns, die in einem CT nicht sichtbar sind, eine verbesserte Bewertung von Patienten mit Rauschzuständen, Bewusstlosigkeit, Sedierung oder Polytrauma und die Identifizierung von Patienten mit dem Risiko, Langzeitfolgen zu entwickeln gehören.1
In einem Artikel aus dem Jahr 2019 in The Lancet Neurology legen Yue et al. nahe, dass durch die Verwendung von Biomarkern der zeitliche Ablauf und die Genauigkeit der Diagnose verbessert sowie die Behandlungs- und Überwachungsstrategien gelenkt werden könnten.2
Die potenziellen Auswirkungen des Einsatzes von Biomarkern bei der Versorgung möglicher SHT-Patienten werden von Bazarian et al. weiter beschrieben. In einem Artikel aus dem Jahr 2018 in The Lancet Neurology stellen die Forscher die These auf, dass bis zu einem Drittel der Kopf-CT-Scans, die in der Akutversorgung zur Bewertung von SHT durchgeführt werden, vermieden werden könnten, und das bei einer sehr geringen Falsch-Negativ-Rate. Außerdem könnte der klinische Einsatz von Biomarkern zu einer Verringerung der Anzahl unnötiger Kopf-CT-Scans, einschließlich der damit verbundenen Strahlenbelastung und Kosten, führen.3
In einem Artikel aus dem Jahr 2018 in The Western Journal of Emergency Medicine argumentieren Michelson et al., dass sich durch die Verringerung der Anzahl unnötiger CT-Scans in der Notaufnahme eine Leistungssteigerung in der Notaufnahme erzielen, die Patientendisposition beschleunigen und die Aufenthaltsdauer reduzieren lassen könnte.4
Korley et al. unterstreichen, wie wichtig es ist, eine grundlegende Veränderung bei der SHT-Behandlung durch diagnostische Fortschritte herbeizuführen. In einem Artikel aus dem Jahr 2015 in The Journal of Head Trauma Rehabilitation versichern die Autoren: „… der Bedarf an neuartigen Diagnosen zur Optimierung der Genauigkeit, Effizienz und Kosteneffektivität von [SHT]-Bewertungen stellt ein wichtiges Anliegen der öffentlichen Gesundheit dar.“5
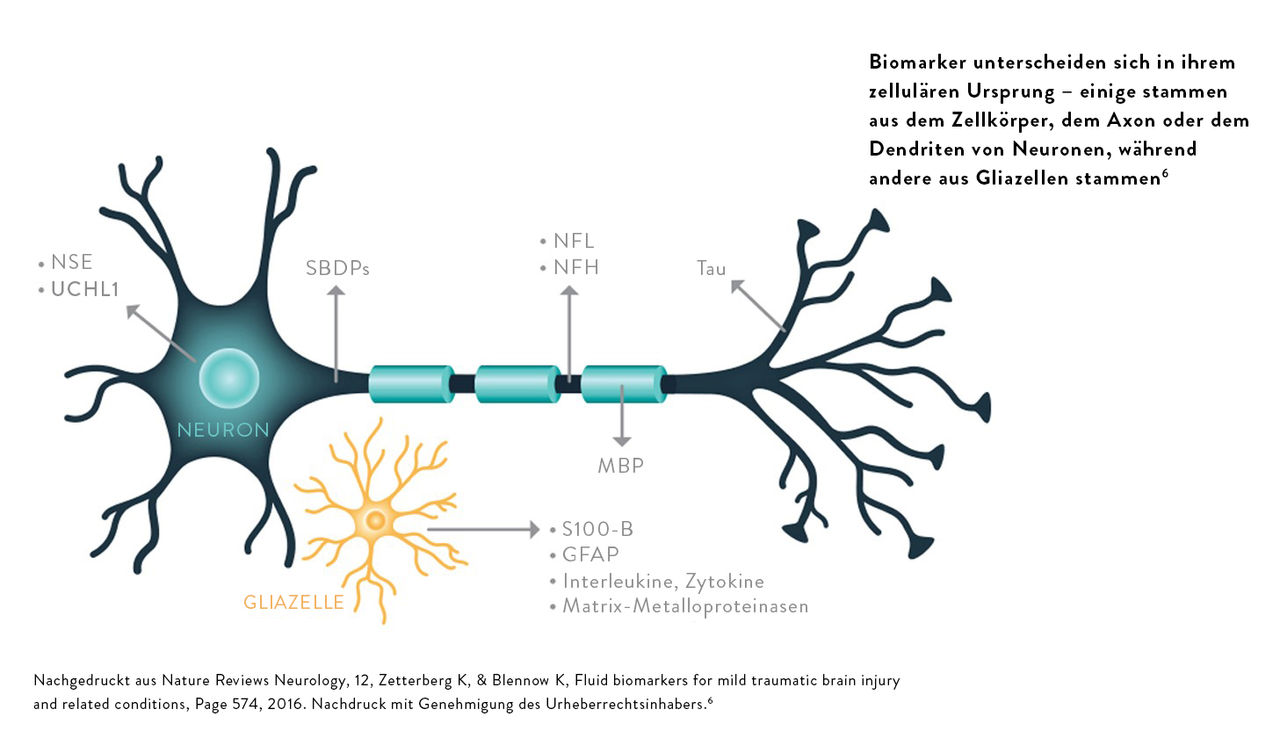
SHTs beeinflussen verschiedene pathophysiologische Abläufe im zentralen Nervensystem. Mithilfe von Tests zum Nachweis von Gehirn-Biomarkern können gehirnspezifische Proteine nachgewiesen und objektive, quantitative Informationen zur Unterstützung der SHT-Bewertung gewonnen werden.
„Nach einer Kopfverletzung werden zerebrovaskuläre Endothelzellen oft mechanisch verformt und durch Scherbelastung geschädigt, was zu einer erhöhten Permeabilität der Tight Junctions und zum Austritt von Molekülen über die Blut-Hirn-Schranke führt. Theoretisch würden diese Ereignisse erhöhte Konzentrationen von Molekülen aus dem ZNS im Blut und von Molekülen aus dem Blut in der Rückenmarksflüssigkeit zur Folge haben.“6
– Zetterberg, Blennow
Damit Biomarker in der Notaufnahme eine diagnostische Aussagekraft haben, werden bestimmte Merkmale als wesentlich erachtet.7,8



Die Biomarkerkonzentration müssen kurz nach Eintritt der Verletzung im peripheren Blut nachweisbar sein



Die Sensitivität des Biomarkers muss hoch genug sein, damit leichte Verletzungen erkannt werden können



Eine erhöhte Biomarkerkonzentration muss spezifisch für ein Kopftrauma sein
Bleiben Sie über das Neueste aus der Biomarkerforschung informiert.


Ubiquitin-Carboxyl-Terminal-Hydrolase (UCH-L1), ein Protein, das am Metabolismus von Ubiquitin beteiligt ist, ist nachweislich kurz nach einer Kopfverletzung im Serum erhöht. Erhöhte Konzentrationen von UCH-L1 im Blut wurden im Serum von Patienten mit leichtem und mittelschwerem SHT innerhalb einer Stunde nach der Verletzung nachgewiesen.9 Die innerhalb von 4 Stunden nach der Verletzung gemessenen Werte waren bei Patienten mit SHT-Läsionen im CT signifikant höher als bei Patienten mit einem normalen intrakraniellen Erscheinungsbild im CT.9 Es wurde festgestellt, dass sich die Blutwerte von UCH-L1 zwischen Patienten mit leichtem SHT und Patienten ohne Kopfverletzungen unterscheiden.9 Die Konzentrationen von UCH-L1 waren bei Patienten, die einen neurochirurgischen Eingriff benötigten, deutlich höher.9
Die Klassifikationsleistung hinsichtlich der Erkennung von intrakraniellen Läsionen im CT bei einem UCH-L1-Cutoff von 0,09 ng/ml ergab eine Sensitivität von 100 % (95-%-KI 88–100), eine Spezifität von 21 % (95-%-KI 13–32) und einen negativen prädiktiven Wert von 100 % (76–100).9



Neuronenspezifische Enolase (NSE) ist ein Enzym, das in neuronalen Zellkörpern im gesamten Nervensystem zu finden ist und nach Kopfverletzungen nachweislich in einer erhöhten Konzentration im Serum vorliegt.9 In mehreren Berichten wird der Nutzen von NSE als Marker für neuronale Verletzungen beschrieben.9-11 Ein Nachteil, über den im Zusammenhang mit der Verwendung von NSE als spezifischem Marker für SHT berichtet wurde, ist seine reichliche Expression in roten Blutkörperchen,8 was Forscher dazu veranlasst hat, bei der Messung von NSE im Blut eine Hämolysekorrektur vorzunehmen.12
Im Rahmen einer Studie wurde die Leistung der NSE-Konzentration im Serum innerhalb von 3 Stunden nach einer Verletzung hinsichtlich der Identifizierung intrakranieller Läsionen bei leichtem SHT untersucht und eine Sensitivität von 56 % und eine Spezifität von 77 % festgestellt.13



Saures Gliafaserprotein (GFAP), ein Strukturprotein der Astrozyten, wurde im Serum innerhalb weniger Stunden nach einer Kopfverletzung nachgewiesen.10 Darüber hinaus unterscheidet GFAP nachweislich zuverlässig zwischen Traumapatienten mit leichtem SHT und solchen ohne Kopfverletzung.10 Die GFAP-Werte im Blut waren bei Patienten mit traumatischen intrakraniellen Anomalien im CT im Vergleich zu Patienten ohne Läsionen erhöht.10 GFAP konnte auch verwendet werden, um vorherzusagen, bei welchen Patienten ein neurochirurgischer Eingriff erforderlich war.10
Die Klassifikationsleistung hinsichtlich der Erkennung von intrakraniellen Läsionen im CT bei einem GFAP-BDP-Cutoff von 0,035 ng/ml ergab eine Sensitivität von 97 % (95-%-KI 82–100), eine Spezifität von 18 % (95-%-KI 11–28) und einen negativen prädiktiven Wert von 94 % (68–100).10



S100 Calcium-bindendes Protein B (S100β) ist ein Calcium-bindendes Protein, das in den Astrogliazellen des Gehirns sehr häufig vorkommt. In mehreren Studien wurde eine signifikante Korrelation zwischen erhöhten Blutwerten von S100β und Anomalien in CT-Scans des Gehirns
festgestellt.14-16 Erhöhte Serumwerte von S100β wurden mit einer höheren Inzidenz des postkommotionellen Syndroms und einer vorübergehenden Beeinträchtigung der kognitiven Fähigkeiten nach einem Trauma in Verbindung gebracht.14,17 Die Untersuchung der Dauer der erhöhten S100β-Werte ergab einen Rückgang dieser mehr als 6 Stunden nach der Verletzung.18
Ein Nachteil von S100β ist, dass es eine schlechte Sensitivität (61 %) und Spezifität (77 %) aufweist,19 was seinen klinischen Nutzen in Notfallszenarien wahrscheinlich begrenzt.7 Erhöhte S100β-Werte wurden bei Patienten mit Frakturen und anderen extrakraniellen Verletzungen festgestellt.20-22 Zusätzlich beeinflussen verschiedene Arten von körperlichen Aktivitäten die S100β-Konzentration bei scheinbar gesunden Sportlern.23 Ein weiterer potenzieller Faktor ist, dass die Hautfarbe die S100β-Konzentration beeinflusst, was nach Ansicht der Studienautoren mit einer verstärkten Expression dieses Proteins durch gesunde Melanozyten zusammenhängen könnte.23,24



Die Konzentrationen von gespaltenen Tau-Proteinmolekülen (c-Tau) in der Rückenmark sflüssigkeit sind nach einem SHT deutlich erhöht; die Konzentrationen des c-Tau-Proteins im peripheren Blut korrelieren jedoch nicht mit dem Vorhandensein von traumatischen Läsionen im CT. Dies begrenzt wahrscheinlich seine Nützlichkeit bei der Diagnose von leichtem SHT in der Notaufnahme.11,12



Bei mittelschwerem und schwerem SHT ist der Spiegel des Spektrin-Abbauprodukts (SBDP) im peripheren Blut erhöht, doch dieser Anstieg wird bei Patienten mit SHT-Melanozyten nicht beobachtet.25



Patienten mit leichtem SHT zeigten einen signifikanten Anstieg des Serumspiegels von hyperphosphorylierten Neurofilamenten (p-NF) an den Tagen 1 (P<0,001) und 3 (P<0,001),25 allerdings kann eine 6-stündige Verzögerung zwischen dem Eintritt der Verletzung und dem Anstieg des Blutspiegels von p-NF die Nützlichkeit dieses Biomarkers als Hilfsmittel bei der Diagnose in der Akutversorgung begrenzen.7



Patienten mit leichtem SHT zeigten einen signifikanten Anstieg des Serumspiegels von hyperphosphorylierten Neurofilamenten (p-NF) an den Tagen 1 (P<0,001) und 3 (P<0,001),25 allerdings kann eine 6-stündige Verzögerung zwischen dem Eintritt der Verletzung und dem Anstieg des Blutspiegels von p-NF die Nützlichkeit dieses Biomarkers als Hilfsmittel bei der Diagnose in der Akutversorgung begrenzen.7
Aus einer wachsenden Zahl von Studien geht hervor, dass einige blutbasierte Neuro-Biomarker einen größeren klinischen Nutzen haben als andere. Drei Biomarker, die eingehend untersucht und mit SHT in Verbindung gebracht wurden, sind S100β und GFAP in Astroglia sowie UCH-L1 in Neuronen.
S100β:
GFAP und UCHL-1
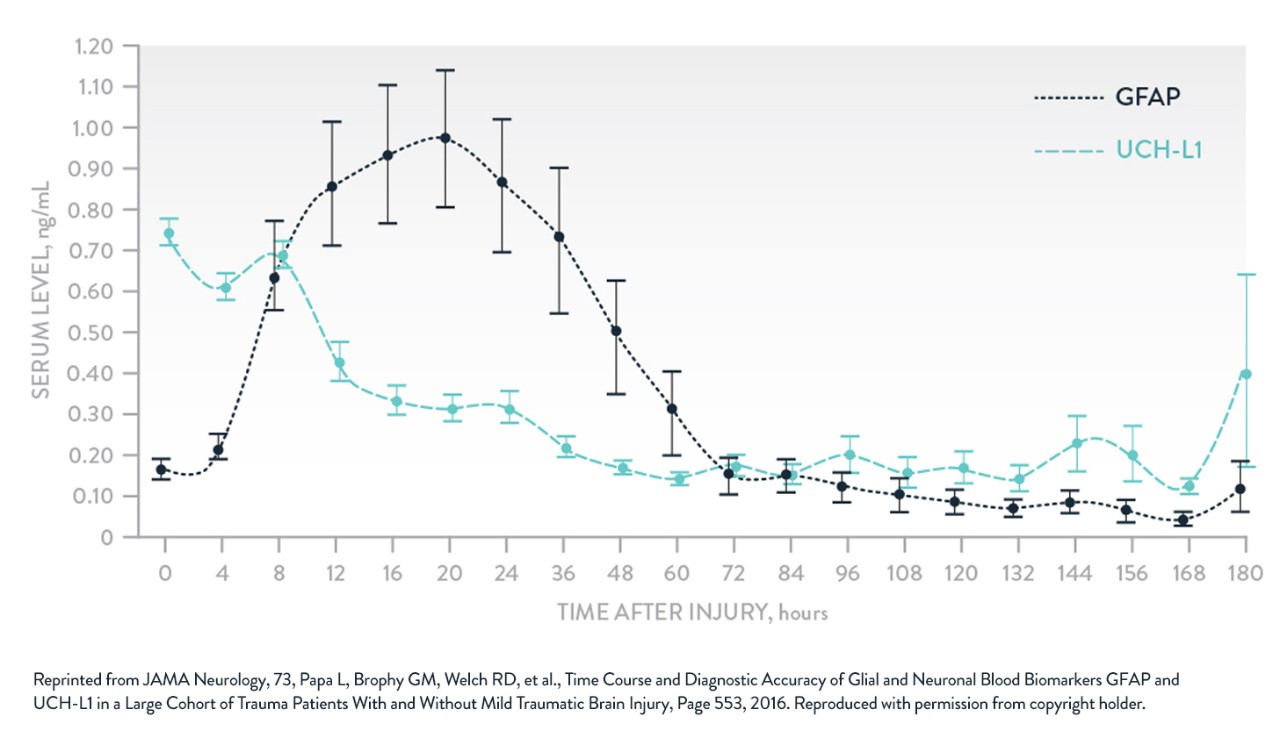
Nach Papa et al. JAMA Neurol. 2016.6
Literaturhinweise:
1. Papa L. Exploring the role of biomarkers for the diagnosis and management of traumatic brain injury patients. INTECH Open Access Publisher. 2012. Verfügbar unter: https://www.intechopen.com/books/proteomics-human-diseases-and-protein-functions/exploring-the-role-of-biomarkers-for-the-diagnosis-and-management-of-traumatic-brain-injury-patients. [Abgerufen am 19. Sep. 2018].
2. Yue JK, Yuh EL, Korley FK, et al. Association between plasma GFAP concentrations and MRI abnormalities in patients with CT-negative traumatic brain injury in the TRACK-TBI cohort: a prospective multicentre study. Lancet Neurol. 2019;18(10):953-961. doi: 10.1016/S1474-4422(19)30282-0.
3. Bazarian JJ, Biberthaler P, Welch RD, et al. Serum GFAP and UCH-L1 for prediction of absence of intracranial injuries on head CT (ALERT-TBI): a multicenter observational study. Lancet Neurol. 2018;17(9):782-789.
4. Michelson EA, Huff JS, Loparo M, et al. Emergency department time course for mild traumatic brain injury workup. West J Emerg Med. 2018;19(4):635-640.
5. Korley FK, Kelen GD, Jones CM, et al. Emergency department evaluation of traumatic brain injury in the united states, 2009–2010. J Head Trauma Rehabil. 2015;31(6):379-387.
6. Zetterberg H, Blennow K. Fluid biomarkers for mild traumatic brain injury and related conditions. Nat Rev Neurol. 2016;12(10):563-574.
7. Jones A, Jarvis P. Review of the potential use of blood neuro-biomarkers in the diagnosis of mild traumatic brain injury. Clin Exp Emerg Med. 2017;4(3):121-127.
8. Wang KK, Yang Z, Zhu T, et al. An update on diagnostic and prognostic biomarkers for traumatic brain injury. Expert Rev Mol Diagn. 2018;18(2):165-180.
9. Ergun R, Bostanci U, Akdemir G, et al. Prognostic value of serum neuron-specific enolase levels after head injury. Neurol Res. 1998;20(5):418-420.
10. Skogseid IM, Nordby HK, Urdal P, et al. Increased serum creatine kinase BB and neuron specific enolase following head injury indicates brain damage. Acta Neurochir. 1992;115:106-111.
11. Ross SA, Cunningham RT, Johnston CF, et al. Neuron-specific enolase as an aid to outcome prediction in head injury. Br J Neurosurg. 1996;10(5):471-476.
12. Verfaillie CJ, Delangh JR. Hemolysis correction factor in the measurement of serum neuron-specific enolase. Clin Chem Lab Med. 2010;48(6):891-892.
13. Kulbe JR, Geddes JW. Current status of fluid biomarkers in mild traumatic brain injury. Exp Neurol. 2016;275:334-335.
14. Ingebrigtsen T, Romner B, Marup-Jensen S, et al. The clinical value of serum S-100 protein measurements in minor head injury: a Scandinavian multicentre study. Brain Injury. 2009;14(12):1047-1055. doi: 10.1080/02699050050203540.
15. Biberthaler P, Linsenmeier U, Pfeifer KJ, et al. Serum S100B concentration provides additional information for the indication of computed tomography in patients after minor head injury. Shock. 2006;25(5):446-453.
16. Muller K, Townend W, Biasca N, et al. S100B serum level predicts computed tomography findings after minor head injury. J Trauma. 2007;62:1452-1456.
17. Waterloo K, Ingebrigtsen T, Romner B. Neuropsychological function in patients with increased serum levels of protein S-100 after minor head injury. Acta Neurochir. 1997;139:26-32.
18. Chabok SY, Moghadam AD, Saneei Z, et al. Neuron-specific enolase and S100BB as outcome predictors in severe diffuse axonal injury. J Trauma Acute Care Surg. 2012;72(6):1654-1657.
19. Nygren de boussard C, Fredman P, Lundin A, et al. S100 in mild traumatic brain injury. Brain Inj. 2004;18(7):671-683.
20. Anderson RE, Hansson LO, Nilsson O, et al. High serum S100B levels for trauma patients without head injuries. Neurosurgery. 2001;48(6):1255-1260.
21. Unden J, Bellner J, Eneroth M, et al. Raised serum S100B levels after acute bone fractures without cerebral injury. J Trauma. 2005;58:59-61.
22. Papa L, Silvestri S, Brophy GM, et al. GFAP Out-Performs S100β in Detecting Traumatic Intracranial Lesions on Computed Tomography in Trauma Patients with Mild Traumatic Brain Injury and Those with Extracranial Lesions. J Neurotrauma. 2014;31(22):1815-1822.
23. Schulte S, Podlog LW, Hamson-Utley JJ, et al. A systematic review of the biomarker S100B: implications for sport-related concussion management. J Athl Train. 2014;49(6):830-850.
24. Abdesselam OB, Vally J, Adem C, et al. Reference values for serum S-100B protein depend on the race of individuals [letter to the editor]. Clin Chem. 2003;49(5):836-837.
25. Gatson JW, Barillas J, Hynan LS, et al. Detection of neurofilament-H in serum as a diagnostic tool to predict injury severity in patients who have suffered mild traumatic brain injury. J Neurosurg. 2014;121(5):1232-1238.
26. Andres R, Mayordomo JI, Zaballos P, et al. Prognostic value of serum S-100B in malignant melanoma. Tumori. 2004;90:607-610.
27. Su YRS, Schuster JM, Smith DH, et al. Cost-effectiveness of biomarker screening for traumatic brain injury. J Neurotrauma. 2019;36:2083-2091.
28. Papa L, Brophy GM, Welch RD, et al. Time course and diagnostic accuracy of glial and neuronal blood biomarkers GFAP and UCH-L1 in a large cohort of trauma patients with and without mild traumatic brain injury. JAMA Neurol. 2016;73(5):551-560.
29. Diaz-Arrastia R, Wang KKW, Papa L, et al. Acute biomarkers of traumatic brain injury: relationship between plasma levels of ubiquitin C-terminal hydrolase-L1 and glial fibrillary acidic protein. J Neurotrauma. 2014;31(1):19-25.
30. Takala RSK, Posti JP, Runtti H, et al. Glial fibrillary acidic protein and ubiquitin c-terminal hydrolase-L1 as outcome predictors in traumatic brain injury. World Neurosurg. 2016;87:8-20.
Links, die Sie auf andere als die globalen Abbott-Websites weiterleiten, liegen außerhalb der Kontrolle von Abbott und Abbott ist nicht für den Inhalt solcher Websites oder für weiterführende Links auf solchen Websites verantwortlich. Abbott stellt Ihnen diese Links der Einfachheit halber zur Verfügung, und die Einbindung eines Links bedeutet nicht, dass Abbott die jeweilige verlinkte Website befürwortet. Die von Ihnen angeforderte Website ist möglicherweise auch nicht für die Größe Ihres Bildschirms optimiert. .
Klicken sie auf „ja“, wenn sie eine medizinische fachkraft sind.